α-シヌクレインは、YKT6の脂質修飾を阻害することによって、細胞外小胞の分泌を抑制する
パーキンソン病(PD)(*1)は、シナプス前タンパク質であるα-シヌクレイン(α-syn)を主成分とするレビー小体の神経細胞内蓄積が生じます。その原因は数十年にわたり研究されてきましたが、未だによく解っていません。順天堂大学医学部神経学講座の服部信孝教授、常深泰司先任准教授、石黒雄太助教授らの研究グループは、細胞外小胞(EV)、特にエクソソーム(*2)がα-synの細胞外放出に関与しており、この経路の障害により細胞内α-synレベルが上昇することを示しました。本研究では、α-synレベルが上昇すると、それ自体がα-synを含むエクソソームの放出を阻害することをH4細胞およびiPSC由来ドパミン(DA)細胞で発見しました。さらに、α-synが増加するにつれ可溶性N-エチルマレイミド感受性因子付着タンパク質受容体(SNARE)タンパク質(*3)であるYKT6(*4)のうち膜関連YKT6が減少しました。これらは、α-synの異常増加がYKT6の脂質修飾を障害することによりエクソソーム分泌を減少させ、DA細胞におけるα-syn蓄積を増悪する悪循環が生じていることを示しています。
本論文はJournal of Neuroscience誌のオンライン版に2025年1月10日付で公開されました。
本研究成果のポイント
- α-シヌクレインの増加によるエクソソームの放出阻害をiPSC由来ドパミンDA細胞で発見。
- α-synが増加するにつれて、膜関連YKT6が減少。
- YKT6のファルネシル化のFTIによる阻害でEV分泌が減少。
背景
シナプス前タンパク質であるα-synの細胞内の発現増加は、孤発性および家族性PDの重大な病因です。これはα-syn遺伝子(SNCA)の重複または三重化や、α-synの分解の障害によっても遺伝性PDが発症することから示唆されています。近年、エクソソームを含む細胞外分泌経路によってα-synが細胞外へ放出され、神経細胞内のα-synレベルに影響を与えることが分かってきました。この分泌経路の障害により細胞内α-synレベルが増加し、分泌促進によりα-synが減少します。またiPSC由来のドパミン細胞ではα-synレベルによってエクソソーム分泌が変化します。よって、エクソソーム分泌経路と細胞内α-synレベルとの詳細な関連を解明し、エクソソームを介したα-syn分泌を調節する細胞経路およびその標的を特定することにより、PDの新たな治療戦略を提供可能と考えました。
内容
H4細胞およびSNCA A53T変異を持つドパミン(DA)細胞において、エクソソーム生成に関与する膜内小胞(ILV)の生成は変化せず、むしろILVを含む多胞体(MVB)の分泌が抑制されていました。この抑制は、リソソームからのカルシウム放出とMVBの酸性化の異常が原因と考えられました。
さらに、α-synはSNAREタンパク質であるYKT6の膜結合を阻害しました。YKT6はMVBと細胞膜の融合に重要な役割を果たしており、YKT6の過剰発現はEV分泌を回復させ、α-synレベルを低下させました。一方、ファルネシル化阻害剤(FTI-277)を投与すると、細胞質のYKT6の膜結合が阻害され、EV分泌がさらに抑制され、細胞内のα-synレベルが増加しました。
以上より、α-synの増加がYKT6の脂質修飾を妨げ、MVBの細胞膜との融合を阻害し、EV分泌を減少させるメカニズムの存在が解明されました。このEV分泌低下は、細胞内のα-syn蓄積をさらに増悪させる悪循環を引き起こすことが示されました。
以上の結果から、パーキンソン病においてα-synが蓄積する新たなメカニズムとしてエクソソームの放出障害が明らかとなりました(図1)。
今後の展開
今回、研究グループはパーキンソン病におけるα-syn蓄積の新たなメカニズムを解明しました。今後、エクソソームを増加させる方法が見つかれば新規治療法として適用されることが考えられます。研究グループはYKT6の脂質修飾を操作する薬剤をスクリーニングする予定です。
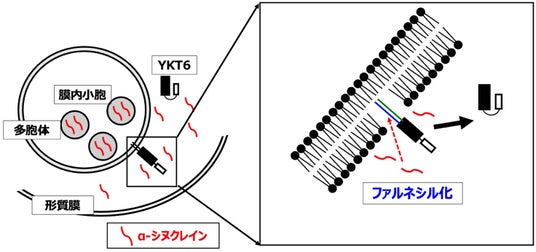
図1:本研究で明らかになったパーキンソン病における新たなα-シヌクレインの蓄積メカ二ズム
YKT6が多胞体に結合し多胞体が形質膜に癒合して多胞体内の膜内小胞を放出するが、増加したα-シヌクレインがYKT6のファルネシル化を阻害し膜結合が減少する。結果として放出されるエクソソームが減少し、細胞内にα-シヌクレインが蓄積する。
用語解説
*1 パーキンソン病: 本邦に約20万人いる運動障害を主症状とする神経変性疾患で根本治療はない。
*2 エクソソーム: 直径50から100ナノメートルの細胞外微粒子の一種。細胞間や組織間の情報伝達に重要な役割を果たしている。
*3 SNAREタンパク質: 細胞内で小胞同士や小胞と形質膜の癒合に重要なタンパク質群。
*4 YKT6: 可溶性SNAREタンパク質で、脂質修飾(ファルネシル化など)により膜へ局在する。
研究者のコメント
●パーキンソン病を含むシヌクレイノパチーにおけるα-シヌクレインが蓄積する新たなメカニズムを発見し、その分子基盤を明らかにした重要な研究です。
●他の神経変性疾患でも同様のメカニズムが働き、細胞内に不溶化タンパク質が蓄積するのか興味が持たれます。
●パーキンソン病の進展にα-シヌクレインの細胞間伝播が重要な役割を果たしており、エクソソームはそこにも関与している可能性が高いです。果たしてエクソソームが善玉なのか悪玉なのかさらなる研究が必要です。
原著論文
本研究はJournal of Neuroscience誌のオンライン版に2025年1月10日付で公開されました。
タイトル: Alpha-synuclein inhibits the secretion of extracellular vesicles through disruptions in YKT6 lipidation
タイトル(日本語訳): α-シヌクレインは、YKT6の脂質修飾を阻害することによって、細胞外小胞の分泌を抑制する
著者: Yuta Ishiguro1), Taiji Tsunemi1), Asako Yoroisaka1), Dou Feng1), Tomoyo Shimada1), Shunichi Niiyama1), Yukiko Sasazawa1) 2) 3), Keiichi Ishikawa1), Wado Akamatsu1), Nobutaka Hattori1) 4)
著者(日本語表記): 石黒雄太1)、常深泰司1)、鎧坂朝子1)、両島1)、島田知世1)、新山俊一1)、笹沢由紀子1) 2) 3)、石川賢一1)、赤松和土、服部信孝1)4)
著者所属: 1)順天堂大学医学部神経学講座、2)順天堂大学大学院医学研究科共同研究講座「オートファジー調節化合物探索研究講座」、3) 順天堂大学大学院医学研究科老人性疾患病態・治療研究センター、4) 理化学研究所 脳神経科学研究センター 神経変性疾患連携研究チーム
DOI: 10.1523/JNEUROSCI.2350-23.2024
本研究はAMED(日本医療研究開発機構)、研究費 JP121ek0109429、AMED研究費 JP22wm0425015、JP24dk0207072、JSPS科研費(日本学術振興会科学研究費)18K07510、21K07444、24K10628、文部科学省私立大学戦略的研究基盤形成事業の支援を受け多施設との共同研究の基に実施されました。なお、本研究にご協力いただいた皆様には深謝いたします。
企業プレスリリース詳細へ
PR TIMESトップへ
本論文はJournal of Neuroscience誌のオンライン版に2025年1月10日付で公開されました。
本研究成果のポイント
- α-シヌクレインの増加によるエクソソームの放出阻害をiPSC由来ドパミンDA細胞で発見。
- α-synが増加するにつれて、膜関連YKT6が減少。
- YKT6のファルネシル化のFTIによる阻害でEV分泌が減少。
背景
シナプス前タンパク質であるα-synの細胞内の発現増加は、孤発性および家族性PDの重大な病因です。これはα-syn遺伝子(SNCA)の重複または三重化や、α-synの分解の障害によっても遺伝性PDが発症することから示唆されています。近年、エクソソームを含む細胞外分泌経路によってα-synが細胞外へ放出され、神経細胞内のα-synレベルに影響を与えることが分かってきました。この分泌経路の障害により細胞内α-synレベルが増加し、分泌促進によりα-synが減少します。またiPSC由来のドパミン細胞ではα-synレベルによってエクソソーム分泌が変化します。よって、エクソソーム分泌経路と細胞内α-synレベルとの詳細な関連を解明し、エクソソームを介したα-syn分泌を調節する細胞経路およびその標的を特定することにより、PDの新たな治療戦略を提供可能と考えました。
内容
H4細胞およびSNCA A53T変異を持つドパミン(DA)細胞において、エクソソーム生成に関与する膜内小胞(ILV)の生成は変化せず、むしろILVを含む多胞体(MVB)の分泌が抑制されていました。この抑制は、リソソームからのカルシウム放出とMVBの酸性化の異常が原因と考えられました。
さらに、α-synはSNAREタンパク質であるYKT6の膜結合を阻害しました。YKT6はMVBと細胞膜の融合に重要な役割を果たしており、YKT6の過剰発現はEV分泌を回復させ、α-synレベルを低下させました。一方、ファルネシル化阻害剤(FTI-277)を投与すると、細胞質のYKT6の膜結合が阻害され、EV分泌がさらに抑制され、細胞内のα-synレベルが増加しました。
以上より、α-synの増加がYKT6の脂質修飾を妨げ、MVBの細胞膜との融合を阻害し、EV分泌を減少させるメカニズムの存在が解明されました。このEV分泌低下は、細胞内のα-syn蓄積をさらに増悪させる悪循環を引き起こすことが示されました。
以上の結果から、パーキンソン病においてα-synが蓄積する新たなメカニズムとしてエクソソームの放出障害が明らかとなりました(図1)。
今後の展開
今回、研究グループはパーキンソン病におけるα-syn蓄積の新たなメカニズムを解明しました。今後、エクソソームを増加させる方法が見つかれば新規治療法として適用されることが考えられます。研究グループはYKT6の脂質修飾を操作する薬剤をスクリーニングする予定です。

図1:本研究で明らかになったパーキンソン病における新たなα-シヌクレインの蓄積メカ二ズム
YKT6が多胞体に結合し多胞体が形質膜に癒合して多胞体内の膜内小胞を放出するが、増加したα-シヌクレインがYKT6のファルネシル化を阻害し膜結合が減少する。結果として放出されるエクソソームが減少し、細胞内にα-シヌクレインが蓄積する。
用語解説
*1 パーキンソン病: 本邦に約20万人いる運動障害を主症状とする神経変性疾患で根本治療はない。
*2 エクソソーム: 直径50から100ナノメートルの細胞外微粒子の一種。細胞間や組織間の情報伝達に重要な役割を果たしている。
*3 SNAREタンパク質: 細胞内で小胞同士や小胞と形質膜の癒合に重要なタンパク質群。
*4 YKT6: 可溶性SNAREタンパク質で、脂質修飾(ファルネシル化など)により膜へ局在する。
研究者のコメント
●パーキンソン病を含むシヌクレイノパチーにおけるα-シヌクレインが蓄積する新たなメカニズムを発見し、その分子基盤を明らかにした重要な研究です。
●他の神経変性疾患でも同様のメカニズムが働き、細胞内に不溶化タンパク質が蓄積するのか興味が持たれます。
●パーキンソン病の進展にα-シヌクレインの細胞間伝播が重要な役割を果たしており、エクソソームはそこにも関与している可能性が高いです。果たしてエクソソームが善玉なのか悪玉なのかさらなる研究が必要です。
原著論文
本研究はJournal of Neuroscience誌のオンライン版に2025年1月10日付で公開されました。
タイトル: Alpha-synuclein inhibits the secretion of extracellular vesicles through disruptions in YKT6 lipidation
タイトル(日本語訳): α-シヌクレインは、YKT6の脂質修飾を阻害することによって、細胞外小胞の分泌を抑制する
著者: Yuta Ishiguro1), Taiji Tsunemi1), Asako Yoroisaka1), Dou Feng1), Tomoyo Shimada1), Shunichi Niiyama1), Yukiko Sasazawa1) 2) 3), Keiichi Ishikawa1), Wado Akamatsu1), Nobutaka Hattori1) 4)
著者(日本語表記): 石黒雄太1)、常深泰司1)、鎧坂朝子1)、両島1)、島田知世1)、新山俊一1)、笹沢由紀子1) 2) 3)、石川賢一1)、赤松和土、服部信孝1)4)
著者所属: 1)順天堂大学医学部神経学講座、2)順天堂大学大学院医学研究科共同研究講座「オートファジー調節化合物探索研究講座」、3) 順天堂大学大学院医学研究科老人性疾患病態・治療研究センター、4) 理化学研究所 脳神経科学研究センター 神経変性疾患連携研究チーム
DOI: 10.1523/JNEUROSCI.2350-23.2024
本研究はAMED(日本医療研究開発機構)、研究費 JP121ek0109429、AMED研究費 JP22wm0425015、JP24dk0207072、JSPS科研費(日本学術振興会科学研究費)18K07510、21K07444、24K10628、文部科学省私立大学戦略的研究基盤形成事業の支援を受け多施設との共同研究の基に実施されました。なお、本研究にご協力いただいた皆様には深謝いたします。
企業プレスリリース詳細へ
PR TIMESトップへ

